Grile
Substanța, după cum știți, poate exista în trei stări: gaze, lichide și solide. De exemplu, oxigenul. care, în condiții normale, este un gaz la o temperatură de -194 ° C în lichid devine albastru, I, la o temperatură -218,8º C într-o masă solidificată zăpadă, care constă din cristale albastre.
În această secțiune ne vom uita la modul în care caracteristicile afectează legăturile chimice asupra proprietăților solidelor. Domeniul de temperatură de existență a substanțelor în stare solidă este determinată prin punctele de topire și de fierbere. Solidele se încadrează în cristalină și amorfă.
substanțe amorfe nu au o temperatură de topire clară - sub încălzire au înmuiat treptat și transferat într-o stare curgător. În stare amorfă, de exemplu, este argila sau rasini diferite.
materiale cristaline sunt caracterizate printr-un aranjament regulat al particulelor din care acestea constau: de atomi, molecule și ioni. - în puncte strict definite în spațiu. Prin conectarea acestor puncte cu linii drepte formează un cadru spațial, care este numit zăbrele. Punctele în care particula are o rețea cristalină numită expusă.
Nodurile pot fi cu zăbrele imaginare ioni, atomi și molecule. Aceste particule oscileze. Cu creșterea temperaturii domeniului de aplicare al acestor vibrații crește, ceea ce duce în general la dilatarea termică a corpurilor.
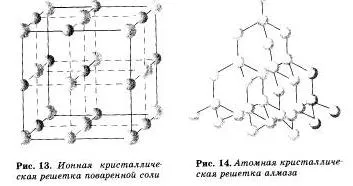
În funcție de tipul de particule dispus într-o rețea cristalină, iar natura legăturii dintre ele patru tipuri de barilor de cristal: ionic, atomic, molecular și metal (tabelul 6.).
Substanțe simple alte elemente care nu sunt menționate în tabelul 6 sunt zăbrele metalice.
Grile ionice Chemat, în care ionii sunt noduri. Aceste substanțe formează legătură ionică, care poate fi conectat ambii ioni simpli Na +, Cl- și SO 2- 4 complex, OH. De aceea, sărurile ionice sunt zăbrele cristaline, unii oxizi și hidroxizi metalici. adică acele substanțe, în cazul în care există o legătură chimică ionică. De exemplu, cristalul de clorură de sodiu este construit alternativ ioni pozitivi de Na + și negativ Cl- formează grilajul în forma unui cub. Comunicarea dintre ionii dintr-un cristal este foarte stabil. Astfel, agenții cu ion reshetnoj au o duritate relativ ridicată și durabilitate, acestea sunt refractare și non-volatile.
Turnat zăbrele atomice de cristal, în nodurile care sunt atomi individuali. In astfel de latici atomii interconectate prin legături covalente foarte puternice. Exemple de substanțe cu acest tip de barilor de cristal poate fi diamant - una dintre modificările alotropice carbon.

Numărul de substanțe cu zăbrele atomice nu este foarte mare. Acestea includ bor cristalin, siliciu și germaniu, și substanțe complexe, de exemplu cele care includ un oxid de siliciu (IV) - SlO2: dioxid de siliciu, cuarț, nisip, piatra de cristal.
Majoritatea compușilor cu o rețea cristalină atomică au puncte foarte ridicate de topire (de exemplu, un diamant este de peste 3500 ° C), acestea sunt puternice și greu, practic insolubil.
Chemat Grile moleculare, care sunt situate la nodurile moleculei. Liantul chimice din aceste molecule pot fi polare și nepolare. In ciuda faptului ca atomii din cadrul moleculelor sunt legate prin legături covalente sunt foarte puternice. între moleculele ei sunt forțe slabe mozhmolekulyarno prima atracție. Astfel, agenții cu zăbrele moleculare au duritate scăzută, cu punct de topire scăzut, volatile.
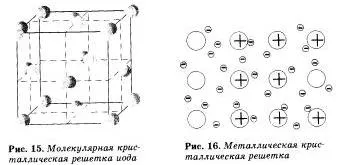
Exemple de substanțe cu laticile moleculare sunt apăconcentratăcare - gheață, oxid de carbon solid (IV) - «gheață uscată“, hidrogen sulfurat solid și acid clorhidric, substanțe solide simple, formate din gaze nobile (cu una), de două ori. trei (O3), patru (P4). molecule vosmiatomnymi. Majoritatea compușilor organici solizi au latici moleculare (naftalină, glucoza, zahăr).
Substanțele cu o legătură metalică au zăbrele de cristal de metal. Nodurile acestor latici sunt atomi și ioni (atomi care, ionii sunt transformați ușor la atomii metalici, dând electronii lor exterioare în uz comun). Astfel de metale structura internă care determină proprietățile lor fizice caracteristice: maleabilitate, plasticitate, conductivitate electrică și termică, un luciu metalic caracteristic.
Pentru substanțele care au o structură moleculară, doar deschide chimist francez JL Proust (1799-1803) legea compoziție constantă. În prezent, această lege este formulată după cum urmează: „Compușii chimici moleculari, indiferent de metoda lor de preparare au o compoziție constantă și proprietăți. legea lui Proust este una dintre legile fundamentale ale chimiei. Cu toate acestea, pentru substanțele cu structură nsmolekulyarnym, cum ar fi un ion, această lege nu este întotdeauna corect.
1. în stare solidă, lichidă și gazoasă a materiei.
2. Solide: amorfă și cristalină.
3. cristalin Lattice: atomic, ionic și metal molecular.
4. Legea proporții definite.
Care sunt proprietățile naftalină sunt baza cererii sale de protecție de articole de îmbrăcăminte din lână de molii?
Care sunt caracteristicile solide amorfe sunt utile pentru opnsaiiya trăsături de caracter ale indivizilor?
De ce să deschidem K. X. aluminiu om de știință danez Oersted în 1825 pentru o lungă perioadă de timp a aparținut metalelor prețioase?
Gândiți-vă produsul A. Belyaeva „aer Vânzător“ și descrie proprietățile oxigenului solid, folosind descrierea dată în carte.
De ce temperatură de topire de metal variază în limite foarte largi? Pentru pregătirea răspunsului la această întrebare, folosiți literatura suplimentară.
De ce este produsul de siliciu în timpul impactului împărțit în bucăți, iar produsul de plumb aplatizate numai? În unele dintre aceste cazuri, este distrugerea legăturii chimice, și în care - nu? De ce?
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.